生命の連続性を支える非コード領域の分子基盤を解明
私たちの研究チームでは、「ゲノム上に散在するトランスポゾン (Transposable elements; TEs) を含む非コード領域が、どのように宿主のゲノム制御や可塑性の獲得に寄与するのか?、また、それによって宿主の自律的な胚発生や機能的な生殖細胞形成がどのように駆動されるのか?」という、哺乳類の発生と生殖における根本的な問いに取り組んでいます。少子化や高齢出産の増加が社会問題となっている昨今、生殖可能年齢の実に6人に1人が不妊に直面しており、高度生殖医療による妊娠成功率も未だ約30%で頭打ちの状態が続いています。さらに近年、晩婚化および生殖補助医療による出生児においては、本来は極めて稀であった遺伝子・エピゲノム疾患の発症頻度が増加傾向にあることが、世界各国で指摘されています。このように、生殖医療の現場では多くの問題が山積する一方、不妊症やゲノム疾患の根本にある機能的な生殖細胞形成や受精後の胚発生制御に関する分子基盤の多くは未解明のままです。そのため、基礎研究によるこれらの分子基盤の解明が、少子高齢化の克服と持続可能社会の実現に向けた喫緊の課題となっています。哺乳類の生殖系列、すなわち生命の連続性を支える重要な分子基盤の一つとして、近年、私たちを含む複数の研究グループは、生物進化の過程で、外部からゲノムに挿入されたTEsが、現生動物の配偶子形成や初期胚発生過程において時空間的に特徴的な発現パターンを示すことを明らかにしてきました。さらに、新たな研究から、こうしたTEsの発現が遺伝的、もしくはエピジェネティックな破綻により損なわれると、不妊や妊娠異常を引き起こす可能性があることが示唆されています。
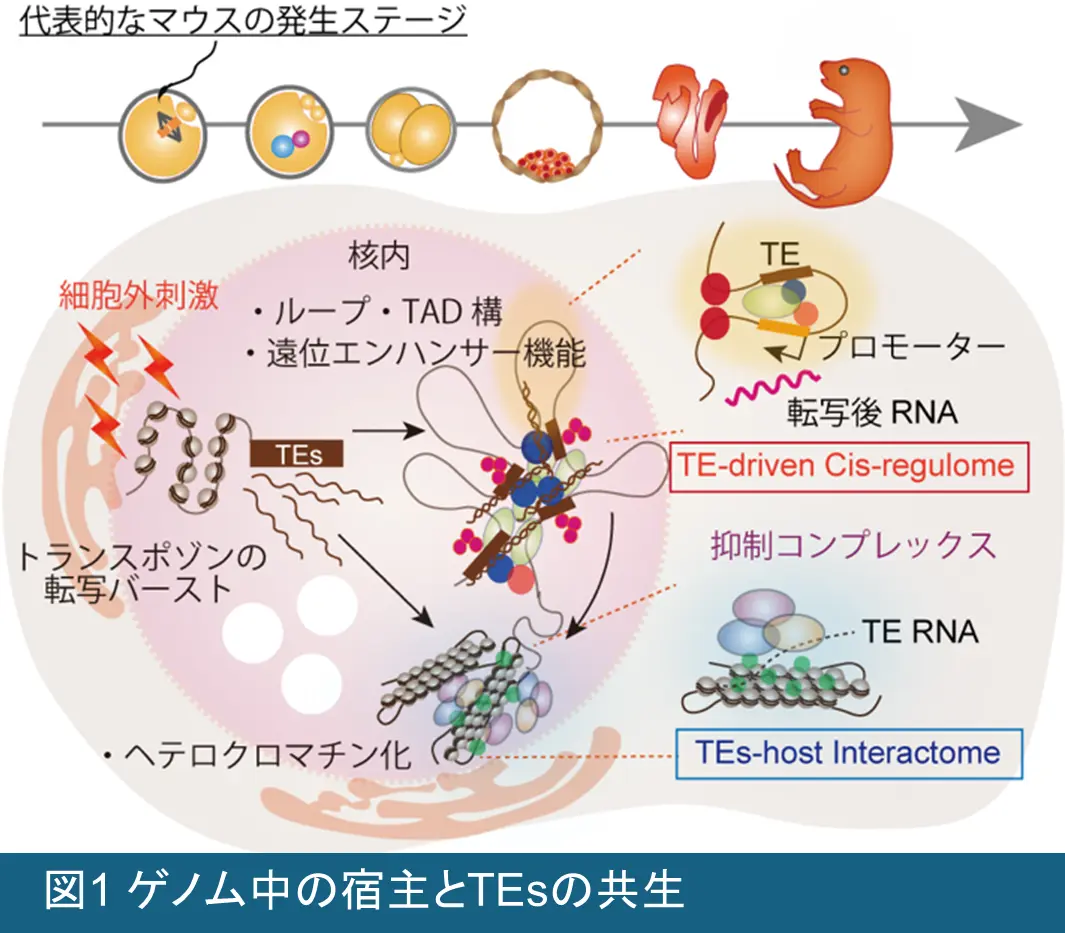
転移活性と自己複製能をもつ外来性遺伝子であるTEsには、LINE・SINE・内在性レトロウイルス(Endogenous retroviruses; ERVs)などが含まれ、長い進化の過程で宿主ゲノム内に、自身の配列情報を蓄積してきました。実際、ヒトやマウスのゲノムの約40〜50%がTEs由来の配列で占められています。従来、TEsは「利己的な遺伝子」として、宿主ゲノムの安定性を脅かす脅威と見なされ、これらの活性化を抑え込む宿主側の抑制機構が着目されてきました。しかし近年の研究により、一部のTEsは進化の過程で宿主ゲノムに取り込まれた後、転写制御やクロマチンリモデリング、3Dゲノム構造の形成に関わる「制御ハブ」として進化してきたことが分かってきました。このようなTEsの「共生・馴化(co-option & domestication)」の事例は、この地球上の多様な生物種において確認されています。
ここで重要なのは、TEs転写の増加が必ずしも転移の活性化を意味しない という点です。多くのTEsはすでに突然変異などで転移能力を失っています。それにもかかわらず、特定のTEs、特に若いERV群は、生殖細胞形成や初期胚発生において特徴的な発現パターンを示します。私たちの最近の研究では、こうしたTEsの発現が、減数分裂を経た配偶子形成や受精後の発生プログラムの開始に不可欠であることを実験的に示してきました。これは従来の概念を覆す発見であり、TEsの機能を網羅的に解析し、ゲノム・エピゲノムの安定性、遺伝子発現、生殖能力、発生の可塑性におけるTEsの役割を解明する新たな道を切り拓くものです。
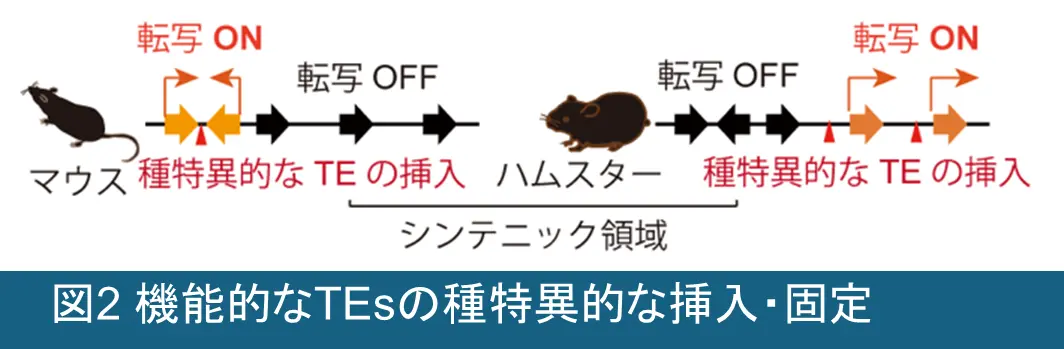
私たちの研究チームでは、ゲノム上の主要部分を占めるTEsが、(1) 生殖系列などの特定の細胞種において、宿主の遺伝子発現プログラムを惹起する転写調節領域として機能すること、加えて、(2) TEsの発現と、それにより駆動される宿主側の認識機構とが協調して働くことで、その後の正常な発生・分化を担保するクロマチン構造が獲得される」という作業仮設を、発生生物学、分子生物学、ならびに情報科学的手法を活用して検証していきます (図1)。さらに、TEsは、それぞれの生物種ごとに固有に挿入・固定化されてきた背景から、TEsによる宿主ゲノム制御が種特異的に進化してきた可能性が考えられるため、進化的側面にも焦点を当て研究を展開していきます (図2)。私たちの研究は、TEsの持つ「二面性」に新たな光を当て、ゲノム科学・発生生物学・生殖医学の融合領域の発展に貢献するものです。私たちは、生殖系列におけるTEsの機能を体系的に解明し、その知見をヒトおよび家畜の生殖医療へと応用することを目指します。私たちは以下の3つの研究項目に基づき、この仮説を検証していきます。
- 研究項目1TEsのクロマチン・転写コードを解読する
超微量オミクス技術を活用し、宿主の発生・分化過程における個々のTEsコピーのエピゲノム・転写動態を解析します。さらに、エピゲノムおよび転写ネットワーク解析に加えて、機械学習を用いた宿主遺伝子やTEsの機能予測・変異シミュレーションを行うことで、発生プロセスに関与する可能性をもつTEs候補を探索します。 - 研究項目2発生・分化、宿主ゲノム制御におけるTEsの機能的役割の解明
独自に開発したマルチターゲティング技術を用いて、ゲノム内に散在する複数のTEsコピーの機能欠失実験を実施します。TEsの発現を欠失させた胚および生殖細胞において、超微量Hi-C・ChIP-seq・RNA-seqなどの統合的オミクス解析を実施し、TEs機能の欠失が、宿主ゲノムのクロマチン構造やそのリモデリングに及ぼす影響を、全ゲノムスケールで明らかにしていきます。 - 研究項目3TEsによる宿主発生制御の種特異的適応の解明
比較ゲノミクスと上述のオミクス解析を活用し、それぞれのTEsが駆動する宿主ゲノム制御機構の進化的保存性と多様性を明らかにしていきます。